由于化学合成法合成能力有限,因此普遍利用将质粒DNA通过体外转录(IVT)方式来实现mRNA的量产。我们已阐述过质粒生产平台的关键工艺流程,经过大肠杆菌的收集、裂解、澄清、纯化得到较高纯度的超螺旋质粒DNA载体。质粒DNA作为mRNA疫苗产品的关键起始原料,基于mRNA序列的结构设计,其需要包含启动子、编码目标蛋白的开放阅读框(ORF)、用以转录成非编码区及Ploy A尾等的DNA序列。环状的质粒DNA需要经过限制性核酸内切酶进行线性化处理,再将其纯化后作为DNA模板,利用T7聚合酶基于互补DNA模板和游离的核苷酸碱基进行IVT反应合成mRNA序列。IVT后需采用DNA酶去除残留的质粒DNA,在利用磁珠法、沉淀法或层析法对mRNA进行纯化、除菌得到mRNA原液(见图1)。
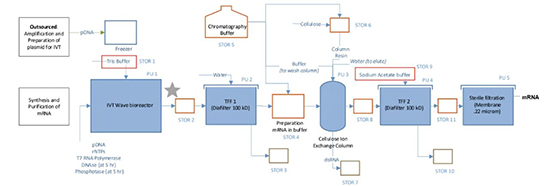
图1 mRNA-IVT生产流程简图
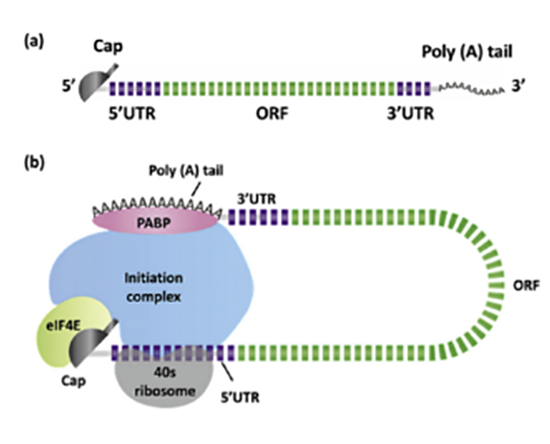
mRNA序列组成部分主要有:5'Cap、非翻译区(UTR)、开放阅读框(ORF)和poly (A)尾。如图2所示,mRNA的5'Cap可以和poly (A)尾结构合作,增强mRNA结构的稳定性。poly (A)尾首先和大量的poly (A)结合蛋白 (PABP)结合,然后募集真核起始因子4E (eIF4G),增加Poly (A)跟5'Cap结构的亲和力,最终mRNA的poly (A)尾巴和5'Cap结构首尾相接,形成环状mRNA。环状mRNA结构有利于核糖体的募集,其特殊的结构也能保护mRNA不被降解。ORF是包含编码所需蛋白质的RNA序列的区域。UTR位于ORF的两侧,分别称为5' UTR和3' UTR。UTR形成二级结构,最终影响蛋白质表达水平,5' UTR在翻译起始中起重要作用,3' UTR则有助于维持mRNA的稳定性。
通常情况下,在IVT过程中我们还需对mRNA序列进行加帽,来提升其稳定性和翻译效率,同时也降低其自身固有的免疫原性。对于加帽反应常见的有两种方式(如图3),一是采用帽类似物的一步共转录加帽,在IVT反应中加入帽类似物与mRNA的5'端结合,这种加帽方式相对简单,但关键问题是加帽效率,因为一些帽类似物的效率较低,如抗反向帽类似物(ARCA)的加帽效率在60-80%,而新型cap类似物如Clean cap可以实现90-99%的加帽效率,使共转录加帽成为更可行的选择。此外,IVT后的酶消化可用于降解未加帽的mRNA。另外,帽类似物相当昂贵,但其共转录加帽可以节省时间,如在疫情大流行情况下需快速生产疫苗,生产效率则是至关重要的。
第二种加帽方式为酶法加帽,其发生在IVT后。首先IVT得到Cap0,然后在牛痘加帽酶和2’-O-甲基转移酶的催化下,再形成帽结构Cap 1或Cap 2,因此增加了整个过程的一步反应。虽然这些转录后酶促反应是一种廉价的替代方法且加帽率较高,但这种方法整体效率偏低。
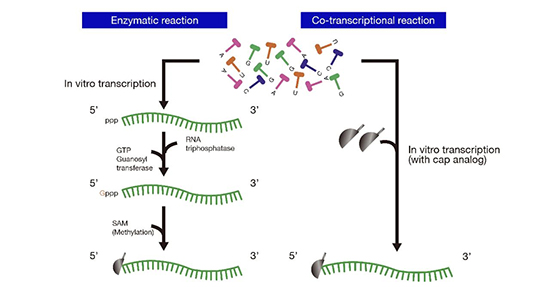
图3 mRNA 加帽方式
大多数真核生物的mRNA 的3'端都有由100~200个腺苷酸聚合形成的Poly(A)尾巴。Ploy(A)尾位于mRNA的3'端,它标志着翻译的结束,其可以通过两种主要方式合并到体外转录的mRNA中。其一,Ploy(A)尾可以设计到DNA模板序列中,因此在IVT过程中Ploy(A)尾会被T7 RNA聚合酶合并到mRNA中。这种加尾方式允许对Ploy(A)尾的长度进行精确控制,因其长度可影响目标蛋白的翻译效率。同时,还可实现多Ploy(A)尾在转录协同作用下添加,无需转录后的额外步骤。其二,加Ploy(A)尾的另一种方法是通过酶促反应在转录后添加。通过poly (A)聚合酶将IVT后的mRNA加上相应长度的poly (A),这个过程非常简单,但缺点是它给整个过程增加了一个额外的步骤,同时,对产生的poly (A)尾长度的精准控制要少很多。然而,poly (A)尾的长度是mRNA翻译效率很关键的影响因素。因此,将poly (A)尾纳入DNA模板设计从效率和其长度控制上都是更具优势的。
IVT反应是一个批处理过程,利用WAVE生物反应器系统的一次性耗材可大大降低我们的清洁验证难度及交叉污染的问题,根据不同规格的选型可处理符合我们IVT反应要求的工作体积,并调控37℃、PH 8.1等条件进行反应。
但IVT反应过程中,会引入很多工艺相关杂质,如dsRNA、 DNAse、磷酸酶、质粒DNA、游离NTP、Triton-X-100、T7 RNA聚合酶、帽类似物、氯化镁、Tris缓冲液、亚精胺和二硫苏糖醇等。因此,在IVT及纯化过程中需要对溶液进行洗滤,以去除杂质。而切向流超滤系统可作为洗滤步骤的首选应用,根据相应的处理规模进行选型,可兼具研发及大生产规模。据mRNA大小可采用100kda截留分子量来对其进行洗滤。纯化后的溶液中会再次引入相关杂质,仍需进行洗滤换液,或直接置换为下游LNP制备时所需的水相mRNA酸性缓冲体系,再进行除菌过滤后得到mRNA原液产品(如图4)。
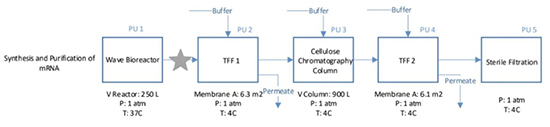
对于mRNA IVT过程涉及的多次TTF而言,科百特的超滤解决方案有膜包及中空纤维两种方式,膜包材质有RC或PES,中空纤维材质有mPES,两者的应用可根据产品工艺及其特性进行倾向性选择或对比测试。对于剪切力相对较敏感或物料粘度/固含量相对较高的,可优选中空纤维进行测试。如常规物料可据实际所需放大规模以及现有硬件系统情况进行选择,针对性优化相应过滤工艺参数后均可实现较高的浓缩洗滤效果,其产品选型可简单参考如图5。
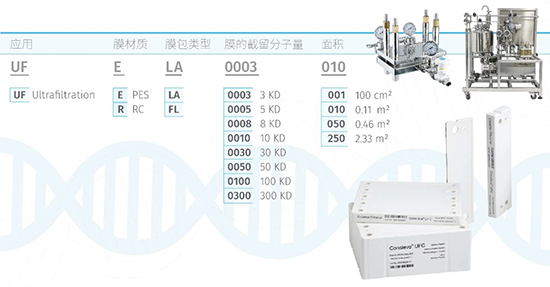

图5 超滤膜包/中空纤维产品选型及配套硬件系统
作为前言治疗药物(ATMP)而言,其法规管理体系尚未足够完善,在生产质量管理方面可参考欧盟颁布的《Guidelines on Good Manufacturing Practice Specific to Advanced Therapy Medicinal Products》、《Annex 1-Manufacture of Sterile Medicinal Products》、《体内基因治疗产品药物研究与评价技术指导原则》(试行)及《新型冠状病毒预防用mRNA疫苗药学研究技术指导原则》(试行)等国内外相关指导原则和法规文件。与ATMP相关的质量风险在很大程度上取决于细胞的生物学特性和来源、载体的生物学特性(例如,复制能力或逆转录)、表达蛋白质的水平和特性、其他非细胞成分的特性(原料、基质)和生产工艺。在确定每种情况下合适的控制/缓解措施时,我们应根据所有可用信息(包括对质量、安全性、有效性的潜在影响评估),评估与产品或生产工艺相关的所有潜在风险以及对人类健康或环境的其他风险。
由于mRNA对RNA酶非常敏感,所以应在生产过程中严格避免与产品直接接触的环境、设备容器具及原辅料中可能引入RNA酶的污染。其中,对于工艺用水及原辅料缓冲液而言,可通过加装10Kd超滤系统对难处理的RNase A进行去除,可有效避免有关RNA酶去除剂的引入,并实现RNA酶的污染防控。对于容器具的使用,工艺流程中可倾向选用经γ辐照或无RNase的一次性产品。同时,mRNA的结构优化设计及杂质dsRNA的有效去除,均可较大程度上降低其带来的免疫副作用等相关问题。基于mRNA疫苗全生命周期的质量管理,一次性耗材产品及密闭系统的应用可较大程度上降低清洁难度、避免交叉污染及环境污染,从而提升工艺开发及生产应用的高效性,并可兼顾多产品多规模共线应用等优势。科百特的一次性产品经第三方检测机构的检测验证,确认无DNase和RNase的残留(部分报告可见图6及图7 ),所以对于mRNA疫苗或其他核酸及细胞基因治疗领域的产品均可放心选用。

图6 科百特一次性产品 无DNase检测

图7 科百特一次性产品 无RNase检测
